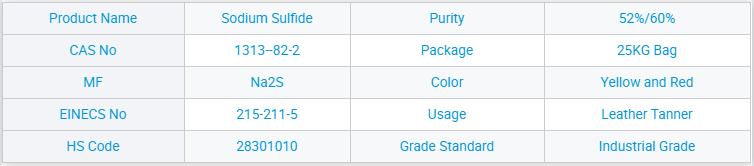
تامین کنندگان برتر، سولفات سدیم 99% بدون آب با فروش داغ Na2so4
ما همچنین بر بهبود مدیریت امور و برنامه کنترل کیفیت تمرکز داریم تا اطمینان حاصل کنیم که میتوانیم سود فوقالعادهای را از این شرکت به شدت رقابتی برای تامینکنندگان برتر، حفظ کنیم. سدیم سولفات ۹۹٪ پر فروش Na2so4 بدون آب. ما از خریداران جدید و قدیمی از هر قشری استقبال میکنیم تا برای روابط تجاری آینده و دستاوردهای مشترک با ما تماس بگیرند!
ما همچنین بر بهبود مدیریت امور و برنامه کنترل کیفیت تمرکز داریم تا اطمینان حاصل کنیم که میتوانیم سود فوقالعادهای را از این شرکت به شدت رقابتی برای ... حفظ کنیم. شرکت ما بر اصل "کیفیت اول، توسعه پایدار" اصرار دارد و "کسب و کار صادقانه، منافع متقابل" را به عنوان هدف قابل توسعه خود در نظر میگیرد. همه اعضا صمیمانه از حمایت همه مشتریان قدیمی و جدید تشکر میکنند. ما به سخت کوشی ادامه خواهیم داد و کالاها و خدمات با بالاترین کیفیت را به شما ارائه خواهیم داد.










 فرآیند تولید سولفید سدیم (Na₂S) سولفات سدیم
فرآیند تولید سولفید سدیم (Na₂S) سولفات سدیم
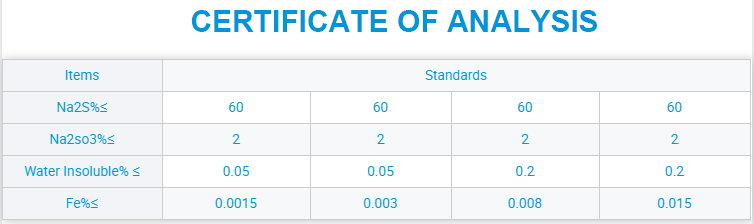
Na₂SO₄ از طریق یک تغذیهکننده خودکار به داخل یک قیف تغذیه میشود و سپس به محفظه احتراق منتقل میشود، جایی که سولفات سدیم دمیده شده و با استفاده از گاز زغال سنگ سوزانده میشود. هنگامی که دما به ۸۸۴ درجه سانتیگراد میرسد، سولفات سدیم به حالت مایع ذوب میشود. Na₂SO₄ محلول از نظر شیمیایی ناپایدار میشود و یونهای SO₄²⁻ به راحتی تجزیه میشوند. یک واکنش جانشینی شیمیایی با استفاده از مونوکسید کربن از گاز زغال سنگ حاوی فسفر به شرح زیر رخ میدهد:
Na2SO4 + 4CO → Na2S + 4CO2
وقتی شعله کوره از آبی به قرمز تغییر میکند، واکنش جایگزینی توسط CO کامل شده است. پس از این نقطه، CO فقط به عنوان سوخت برای افزایش بیشتر دما عمل میکند. وقتی دما به ۱۱۰۰ درجه سانتیگراد میرسد، مقدار کمی آنتراسیت اضافه میشود. نقطه پایانی واکنش با ظاهر شدن شعله زرد درخشان در داخل کوره مشخص میشود. واکنش شیمیایی به شرح زیر است:
Na2SO4 + 2C → Na2S + 2CO2
سولفات سدیم.




















